Fatiga posviral: síntomas, tiempo de recuperación y apoyo basado en la evidencia

La fatiga postviral se ha convertido en una de las consecuencias más ampliamente reportadas de las enfermedades virales en los últimos años, en particular en el contexto de la COVID-191. A diferencia del cansancio transitorio esperado durante una infección aguda, la fatiga postviral se refiere a un agotamiento persistente y debilitante y a una disfunción cognitiva que pueden durar semanas o meses después de la enfermedad inicial2.
Esta condición refleja un desequilibrio fisiológico más profundo que involucra el sistema nervioso autónomo, la señalización inmunitaria, la función vascular y el metabolismo celular3,4,5,6. En algunas personas, los síntomas persisten más allá de los tres meses y evolucionan hacia el síndrome de fatiga postviral, una condición que presenta una fuerte superposición con la fatiga persistente6,7,8,9.
Este artículo explora los mecanismos subyacentes, los patrones de síntomas y las estrategias terapéuticas basadas en la evidencia que apoyan la recuperación de la fatiga postviral, incluido el papel emergente de la neuromodulación10,11,12,13.
Comprender la fatiga postviral
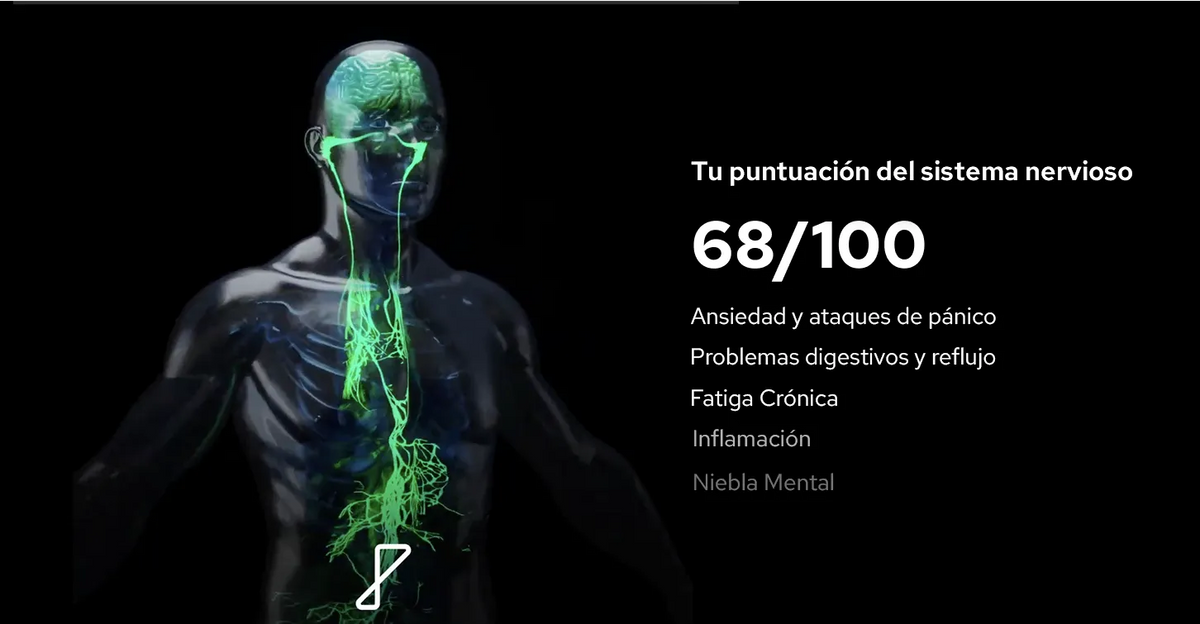
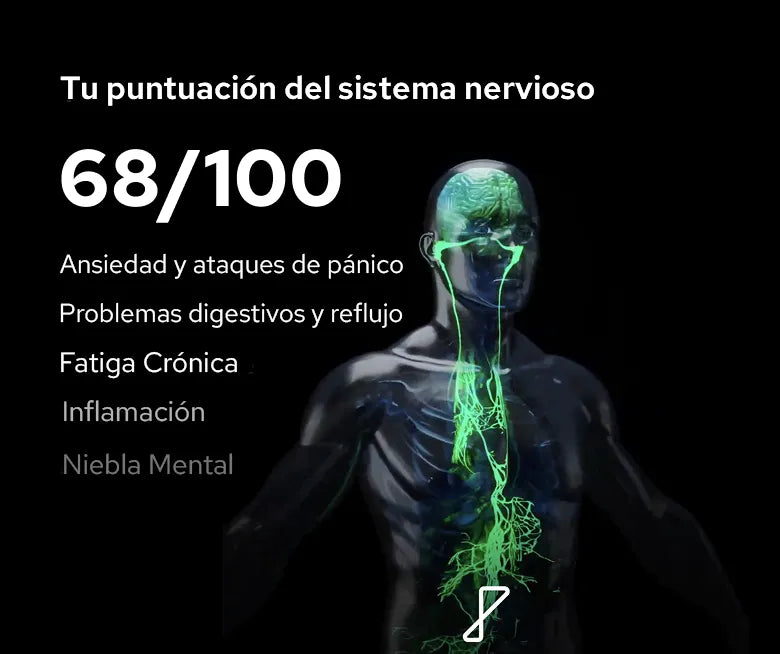
La fatiga postviral se define como un agotamiento prolongado, una reducción de la capacidad física y un enlentecimiento cognitivo tras una enfermedad viral14. No se alivia con el descanso y suele asociarse con intolerancia al ejercicio, pesadez muscular, dolores de cabeza, fiebre de bajo grado y síntomas de disfunción autonómica, como palpitaciones o mareos2. Estos síntomas surgen a partir de alteraciones biológicas desencadenadas por la propia infección y por las respuestas inflamatorias y autonómicas posteriores del organismo2,3.
La activación inmunitaria persistente desempeña un papel importante. Incluso después de que el virus haya desaparecido, los mediadores inflamatorios pueden permanecer elevados, afectando a los circuitos neuronales implicados en la regulación de la energía y la cognición2. Esto contribuye al característico “niebla mental”, a la reducción de la resistencia cognitiva y al enlentecimiento motivacional que suelen reportar los pacientes6.
La disfunción autonómica es igualmente central: las enfermedades virales pueden reducir el tono vagal (parasimpático) y promover el predominio simpático, alterando la homeostasis fisiológica y perpetuando la fatiga3.
El perfil sintomático de la fatiga postviral
La fatiga postviral se presenta con un patrón de síntomas distintivo y, a menudo, reconocible. Las personas suelen describir un agotamiento profundo y desproporcionado que limita incluso las actividades diarias básicas, acompañado de enlentecimiento cognitivo o “niebla mental”, dificultad para concentrarse y lapsos de memoria a corto plazo2,6. El sueño suele ser poco reparador a pesar de su larga duración, lo que refleja una disrregulación autonómica subyacente. Muchas personas también experimentan respuestas exageradas de la frecuencia cardíaca, palpitaciones, mareos, dificultad respiratoria con el esfuerzo, inestabilidad de la temperatura o una fiebre leve “postviral”14.
Estos síntomas tienden a fluctuar, pero empeoran de forma predecible tras esfuerzos físicos, cognitivos o emocionales muy modestos. Los intentos de “seguir adelante” suelen desencadenar recaídas sintomáticas retardadas que duran días o semanas, lo que pone de relieve la capacidad fisiológica reducida y la inestabilidad energética características de la fatiga postviral6,7.
¿Qué es el síndrome de fatiga postviral?
Cuando los síntomas persisten durante más de 12 semanas y afectan de forma significativa a la vida diaria, las personas pueden cumplir los criterios de síndrome de fatiga postviral14. Esta forma más prolongada comparte una importante superposición biológica con la fatiga persistente, también denominada Enfermedad de Intolerancia Sistémica al Esfuerzo (SEID)7,8.
El síndrome de fatiga postviral y su superposición con la fatiga persistente
Un rasgo distintivo de la fatiga persistente y cada vez más reconocido en la fatiga postviral es el malestar post-esfuerzo (PEM), un empeoramiento retardado y desproporcionado de los síntomas tras un esfuerzo físico, cognitivo o emocional7,9. El PEM refleja una producción energética celular alterada y una inestabilidad autonómica6, lo que distingue la fatiga postviral de un simple desacondicionamiento.
La investigación epidemiológica sugiere que los patrones persistentes de síntomas postvirales, incluidos los descritos en estudios sobre fatiga persistente, pueden afectar hasta a ~1% de la población⁸. Esta superposición subraya la importancia de enfoques que se basen en la investigación sobre la inflamación, los cambios autonómicos y la función vascular2,3,4,5.
¿Cuánto tiempo dura la fatiga postviral?
Los tiempos de recuperación varían ampliamente, y muchas personas se recuperan en un plazo de cuatro a doce semanas a medida que se estabilizan los sistemas inmunitario y autonómico14. Sin embargo, un número considerable —en particular en cohortes de fatiga postviral— experimenta fatiga persistente durante tres a doce meses o más. Los estudios informan que entre el 30 y el 60% de las personas que se recuperan de la COVID-19 continúan experimentando fatiga meses después, incluso tras una enfermedad leve1,2.
La fatiga postviral también ha revelado importantes patrones demográficos: los síntomas postvirales persistentes parecen ser más frecuentes en mujeres15 y en adultos jóvenes o de mediana edad1. Esta tendencia puede reflejar una reactividad inmunitaria ligada al sexo, una mayor producción de autoanticuerpos6,21 y una mayor susceptibilidad a la disautonomía3.
En una pequeña proporción de personas, los síntomas se vuelven crónicos y pueden requerir un manejo a largo plazo7,8.
Mecanismos biológicos que impulsan la fatiga postviral
1. Disfunción del sistema nervioso autónomo
La reducción del tono vagal deteriora la capacidad del organismo para regular la inflamación, la frecuencia cardíaca, la digestión y las respuestas al estrés. Este desequilibrio autonómico crea un ciclo de fatiga, intolerancia al esfuerzo y sobreactivación simpática3.
2. Activación inmunitaria persistente
Los mediadores inflamatorios pueden permanecer elevados mucho después de que se resuelva la infección aguda, manteniendo síntomas como dolor, disfunción cognitiva y malestar general2.
3. Disfunción microcirculatoria y endotelial
Investigaciones emergentes muestran que muchos síndromes postvirales, incluidos la fatiga postviral y la fatiga persistente, están asociados con hipercoagulabilidad y microcoágulos que pueden deteriorar el flujo capilar4,5. Estos microcoágulos fibrinoides pueden contribuir a la inflamación endotelial, a una menor entrega de oxígeno, a la pesadez muscular y a la niebla mental4.
4. Estrés oxidativo y carga mitocondrial
El desequilibrio oxidativo afecta a la producción mitocondrial de ATP —la principal fuente de energía del organismo—. Esto puede explicar la fatiga profunda y persistente que experimentan muchos pacientes postvirales6.
Recuperación de la fatiga postviral
La recuperación suele requerir una estrategia de múltiples capas centrada en el pacing, el apoyo autonómico y la estabilización metabólica. El pacing de la actividad es una de las herramientas más importantes, ya que ayuda a las personas a evitar el ciclo de altibajos que empeora los síntomas7. La estabilización de los patrones de sueño, el mantenimiento de una nutrición equilibrada y la incorporación de movimiento suave dentro de límites tolerables pueden apoyar la recuperación14.
Las técnicas de respiración, la atención plena y otras prácticas que promueven la activación parasimpática también pueden ser beneficiosas3. Muchas personas también se benefician de la reintroducción gradual de tareas cognitivas en intervalos cortos y manejables para evitar la sobrecarga mental, ya que la fatiga cognitiva a menudo refleja a la fatiga física en su patrón de recaída2.
Apoyar la hidratación y el equilibrio electrolítico puede mejorar aún más la estabilidad energética, en particular en quienes experimentan fluctuaciones autonómicas3. Algunas personas encuentran que las rutinas estructuradas —como pausas de descanso planificadas, horarios de comidas constantes y ritmos diarios predecibles— ayudan a reducir el estrés fisiológico y a mejorar el impulso de la recuperación14.
El papel de la estimulación del nervio vago
Entre las terapias no farmacológicas, la estimulación transcutánea del nervio vago (tVNS) ha ganado atención por su potencial para influir en varios impulsores biológicos de la fatiga postviral10,11,12,13. Al estimular la rama auricular del nervio vago, la tVNS influye en vías que regulan la inflamación, el equilibrio autonómico, la función vascular y la comunicación cerebro–cuerpo, todas ellas alteradas en los síndromes postvirales2,3,4,5.
Neuromodulación de la inflamación y la función autonómica
El nervio vago desempeña un papel central en el control de la inflamación sistémica a través del reflejo antiinflamatorio colinérgico12. Cuando se activa, puede reducir la liberación de citocinas proinflamatorias como el TNF-α y modular la actividad inmunitaria10,11. Los estudios han demostrado que la tVNS puede influir en la salida autonómica, aumentando la actividad parasimpática y reduciendo la sobreactivación simpática3 —dos mecanismos estrechamente implicados en los síntomas postvirales2,3.
Investigación reciente y evidencia en crecimiento
La investigación sobre la neuromodulación vagal auricular (AVNT) ha mostrado resultados alentadores:
-
Reducción de la fatiga: En grupos postvirales, la AVNT se ha asociado con mejoras significativas de la fatiga, incluida una reducción del 48% en la gravedad de la fatiga y un 57% de alivio de los síntomas persistentes de fatiga¹⁶.
-
Mejoras endoteliales y microcirculatorias: Se ha demostrado que la AVNT mejora la capacidad de respuesta endotelial y el flujo capilar13,17, abordando un factor clave de la pesadez muscular y el enlentecimiento cognitivo4.
-
Regulación autonómica: Los estudios muestran mejoras en la ganancia del barorreflejo cardiovagal, un biomarcador clave de la estabilidad autonómica18.
-
Mejoras del sueño y la cognición: Investigaciones tempranas muestran beneficios en la calidad del sueño, la atención y la claridad mental en personas con fatiga de larga duración19,20.
-
Reducción de la inflamación: La tVNS ha reducido marcadores inflamatorios como el TNF-α y la PCR en varias poblaciones clínicas10,11.
Estos efectos combinados sugieren que la tVNS actúa sobre múltiples vías que contribuyen a la fatiga postviral.
Contrarrestar el estrés oxidativo residual de la fatiga postviral
El estrés oxidativo es un contribuyente bien documentado al metabolismo enlentecido y a la reducción de la energía celular observados en las condiciones postvirales6. Los estudios sobre la estimulación de bajo nivel del trago muestran reducciones en biomarcadores de estrés oxidativo17, lo que apunta a un mecanismo adicional mediante el cual la tVNS puede apoyar la recuperación al mejorar la disponibilidad energética y reducir la carga metabólica6.
Evidencia en cohortes de fatiga postviral y fatiga persistente
Más allá de la investigación cardiovascular, la tVNS también se ha investigado en condiciones similares a la fatiga postviral. Un estudio piloto en fatiga postviral informó mejoras en la fatiga, el estado de ánimo, el tono autonómico y la función física, incluida la fuerza de prensión16,19. Hallazgos similares se han reportado en investigaciones con cohortes de síntomas de fatiga persistente, mostrando aumentos de la variabilidad de la frecuencia cardíaca, reducciones de citocinas inflamatorias y mejoras del estado de ánimo y los niveles de energía10,11,20, en consonancia con los objetivos biológicos más relevantes para la fatiga postviral2,3,6.
Seguridad y tolerabilidad
Una revisión de más de 200 pacientes que recibieron tVNS auricular no informó eventos adversos graves relacionados con el dispositivo, registrándose únicamente sensaciones leves y temporales en una minoría de usuarios22. Este sólido perfil de seguridad subraya a la tVNS como una de las técnicas de neuromodulación mejor toleradas disponibles en la actualidad17,18.
tVNS auricular en sistemas portátiles no invasivos
El acceso a sistemas portátiles no invasivos diseñados para la neuromodulación auricular ha aumentado en los últimos años, proporcionando a las personas formas estructuradas de apoyar la recuperación autonómica en el hogar22.
Para las personas que exploran herramientas de neuromodulación validadas, Nurosym representa un sistema portátil no invasivo diseñado para ofrecer neuromodulación auricular sensorial específica que puede integrarse en rutinas más amplias de autogestión para personas que viven con síntomas postvirales persistentes. Su diseño se centra en proporcionar una estimulación vagal controlada y sensorialmente específica con parámetros de forma de onda consistentes, características alineadas con las recomendaciones actuales sobre parámetros de neuromodulación10,11,12,13,17,18. Los parámetros de estimulación utilizados en Nurosym se alinean con los explorados en estudios publicados sobre función autonómica, respuestas endoteliales y síntomas de fatiga16,18,19.
Aunque no está destinado a ser un tratamiento independiente, los sistemas de neuromodulación auricular domiciliarios como Nurosym pueden ayudar a apoyar la regulación autonómica cuando se utilizan junto con el pacing, la optimización del sueño y ajustes del estilo de vida, ayudando a estabilizar las vías reguladoras inherentes del organismo3.
Evidencia basada en la investigación de Nurosym
Nurosym ha sido evaluado en más de 50 estudios clínicos y en más de 4 millones de sesiones de pacientes, sin que se hayan reportado eventos adversos graves relacionados con el dispositivo hasta la fecha y solo sensaciones leves y de corta duración en un pequeño número de usuarios16,22. Este perfil de seguridad consistentemente sólido proporciona una base de evidencia sustancial para explorar Nurosym como parte de las estrategias de recuperación postviral.
En grupos con fatiga postviral, Nurosym se ha asociado con reducciones significativas de los síntomas. Un estudio de un solo grupo encontró que el 77% de los participantes informó mejoras en la fatiga, la niebla mental, los problemas gastrointestinales, el estrés y el bajo estado de ánimo en el plazo de un mes. En conjunto, las puntuaciones de fatiga mejoraron aproximadamente un 48%, las puntuaciones de síntomas depresivos disminuyeron alrededor de un 45%, y los usuarios informaron beneficios en la calidad del sueño y la claridad cognitiva16,19,20. En grupos que experimentaban síntomas de fatiga prolongada y enlentecimiento cognitivo, Nurosym se asoció con una mejora media del 57% en medidas relacionadas con la cognición, incluida la atención, el rendimiento de aprendizaje y las tareas de memoria.
Estas mejoras sintomáticas se alinean con cambios fisiológicos medibles. Los estudios con Nurosym han mostrado aumentos de la variabilidad de la frecuencia cardíaca (VFC) de hasta ~61%, mejoras de la capacidad de respuesta endotelial y de la variabilidad de la presión arterial17,18, así como reducciones sustanciales de marcadores inflamatorios como el TNF-α y la IL-8, además de disminuciones del neuropéptido Y, que se asocia con el estrés y la neuroinflamación²².
En conjunto, estos hallazgos indican que Nurosym actúa sobre sistemas biológicos clave afectados en la fatiga postviral —el equilibrio autonómico, la señalización inflamatoria, la función vascular y el rendimiento cognitivo—, apoyando su uso como una herramienta estructurada para el hogar dentro de planes más amplios de autogestión y recuperación basada en el pacing.
 Figura: Puntuaciones de síntomas de fatiga postviral en el Día 0 (D0), Día 5 (D5), Día 10 (D10) y Día 17 (D17). Los participantes informaron una marcada disminución de la intensidad global de los síntomas a lo largo del periodo de estimulación de 10 días, con mejoras aún visibles una semana después de completar las sesiones.
Figura: Puntuaciones de síntomas de fatiga postviral en el Día 0 (D0), Día 5 (D5), Día 10 (D10) y Día 17 (D17). Los participantes informaron una marcada disminución de la intensidad global de los síntomas a lo largo del periodo de estimulación de 10 días, con mejoras aún visibles una semana después de completar las sesiones.
 Fig. Puntuaciones de la escala de fatiga de Pichot durante la terapia con Nurosym (D0: día 0, D5: día 5 y D10: día 10). Se observó una mejora significativa de las puntuaciones de fatiga tras el tratamiento con Nurosym (D0 vs. D10; p < 0,0001). (Parasym ensayo clínico, 2021).
Fig. Puntuaciones de la escala de fatiga de Pichot durante la terapia con Nurosym (D0: día 0, D5: día 5 y D10: día 10). Se observó una mejora significativa de las puntuaciones de fatiga tras el tratamiento con Nurosym (D0 vs. D10; p < 0,0001). (Parasym ensayo clínico, 2021).
Conclusión
La fatiga postviral es un conjunto complejo de síntomas, sustentado por disfunciones biológicas medibles que involucran la inflamación2, el desequilibrio autonómico2,3, la alteración vascular4,5 y el estrés oxidativo6. Aunque la recuperación puede ser gradual, la evidencia emergente respalda una combinación de pacing, regulación del estilo de vida y enfoques que abordan estos mecanismos subyacentes.
La evidencia hasta la fecha sugiere que la estimulación transcutánea auricular del nervio vago (tVNS) es un enfoque prometedor y bien tolerado para apoyar aspectos de la recuperación postviral. En la práctica, los sistemas portátiles no invasivos como Nurosym ofrecen una forma estructurada de aplicar este enfoque de neuromodulación en casa, permitiendo a las personas integrar el apoyo autonómico en sus rutinas diarias. A medida que la investigación continúa, la neuromodulación puede convertirse en una herramienta cada vez más importante para ayudar a las personas a reconstruir energía, resiliencia y salud a largo plazo11.
Descargo de responsabilidad: Este contenido es solo para fines informativos y no constituye asesoramiento médico. Nurosym no diagnostica, trata, cura ni previene ninguna condición médica.
Referencias
-
Raveendran AV, Jayadevan R, Sashidharan S. Long COVID: An overview. Diabetes Metab Syndr. 2021;15(3):869–875.
-
Proal AD, VanElzakker MB. Long COVID or Post-acute Sequelae of COVID-19 (PASC): An overview of biological factors that may contribute to persistent symptoms. Front Microbiol. 2021;12:698169.
-
Dani M, Dirksen A, Taraborrelli P, et al. Autonomic dysfunction in “long COVID”: Rationale, physiology and management strategies. Clin Med (Lond). 2021;21(1):e63–e67.
-
Nunes JM, Kruger A, Proal A, Kell DB, Pretorius E. The occurrence of hyperactivated platelets and fibrinaloid microclots in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS). Pharmaceuticals (Basel). 2022;15(8):931.
-
Pretorius E, Vlok M, Venter C, et al. Persistent clotting protein pathology in Long COVID/Post-Acute Sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin. Cardiovasc Diabetol. 2021;20:172.
-
Gerwyn M, Maes M. A neuro-immune model of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Metab Brain Dis. 2013;28(4):523–540.
-
Clinical practice guidelines for Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Mayo Clin Proc. 2021;96(11):2861–2878.
-
Clayton EW. Beyond Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: An IOM report on redefining an illness. JAMA. 2015;313(11):1101–1102.
-
Komaroff AL et al. Clinical characteristics of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome diagnosed in patients with Long COVID. Medicina (Kaunas). 2022;58(7):850.
-
Fudim M, Qadri YJ, Ghadimi K, et al. Implications for neuromodulation therapy to control inflammation and related organ dysfunction in COVID-19. J Cardiovasc Transl Res. 2020;13(6):894–899.
-
Bonaz B, Sinniger V, Pellissier S. Therapeutic potential of vagus nerve stimulation for inflammatory bowel diseases. Front Neurosci. 2021;15:650971.
-
Tracey KJ, referenced in: The role of the vagus nerve in fibromyalgia syndrome. Neurosci Biobehav Rev. 2021;131:1136–1149.
-
Dasari TW, Csipo T, Amil F, et al. Effects of low-level tragus stimulation on endothelial function in heart failure with reduced ejection fraction. J Card Fail. 2021;27(5):568–576.
-
National Institute for Health and Care Excellence (NICE). COVID-19 rapid guideline: managing the long-term effects of COVID-19 (NG188). 2020.
-
Boseley S. Why are women more prone to Long Covid? The Guardian. 13 June 2021.
-
Parasym Health. Auricular Vagal Neuromodulation Therapy (AVNT) Reduces Fatigue in Post-Viral Syndrome Patients: Single-Group Assignment Study. London (UK): Parasym; 2021. Available from: https://nurosym.org/pages/auricular-vagal-neuromodulation-therapy-avnt-reduces-fatigue-in-one-group-assignment-in-post-viral-syndrome-patients
-
Nagai M, Dote K, Kato M, Sasaki S, Oda N, Po SS, et al. Blood pressure variability after non-invasive low-level tragus stimulation in acute heart failure. J Cardiovasc Transl Res. 2024;17(6):1347–1352. doi:10.1007/s12265-024-10544-4. PMID:38969912.
-
Gentile F, Giannoni A, Navari A, Degl'Innocenti E, Emdin M, Passino C. Acute right-sided transcutaneous vagus nerve stimulation improves cardio-vagal baroreflex gain in patients with chronic heart failure. Clin Auton Res. 2025;35(1):75–85. doi:10.1007/s10286-024-01074-9. PMID:39402309; PMCID:PMC11937132.
-
Parasym Health. Auricular Vagal Neuromodulation Therapy Improves Sleep Scores in Long COVID: A Pilot Study. London (UK): Parasym; 2024. Available from: https://nurosym.org/pages/auricular-vagal-neuromodulation-therapy-improves-sleep-score-in-long-covid-a-pilot-study
-
Parasym Health. Attention Deficiency Symptoms Reduction in Post-Viral Syndrome Patients After Auricular Vagal Neuromodulation Therapy: Single-Group Study. London (UK): Parasym; 2022. Available from: https://nurosym.org/pages/attention-deficiency-symptoms-reduction-in-post-viral-syndrome-patients-after-auricular-vagal-neuromodulation-therapy
-
Wirth K, Scheibenbogen C. A unifying hypothesis of the pathophysiology of ME/CFS: recognition from the finding of autoantibodies against β₂-adrenergic receptors. Autoimmun Rev. 2020;19(6):102527.
-
Dalle Luche G et al. Safety and tolerability of low-level tragus vagal neuromodulation in cardiovascular patients. J Am Coll Cardiol. 2024;83(Suppl A):178.